10. srpna 2007
Projekt prof. Rašky: "Jadérko: Nejen továrna na ribosomy"
Jadérko (nukleolus) je jadernou organelou (subkompartmentem) a v mikroskopu se jeví jako nejnápadnější jaderná struktura. Právě proto bylo, na rozdíl od jádra objeveného zhruba o 50 let později, popsáno již těsně před Velkou francouzskou revolucí. Určení jeho funkce v buňce, resp. určení jeho "hlavní" (kanonické) funkce, jsme se dočkali v šedesátých letech 20. století. Teprve tehdy bylo prokázáno, že jadérko obsahuje ribosomální geny a představuje továrnu na ribosomy. Jak se však zmíníme, nukleolus nám připravil překvapení a nálezy z posledních let svědčí o řadě neribosomálních (nekanonických) funkcí jadérka.
Jadérko je místem přepisu (transkripce) ribosomálních genů do ribosomální RNA. Nejprve se syntetizuje dlouhý prekursor ribosomálních molekul RNA, sestávající (v lidské buňce) ze sekvence bezmála 14 tisíc nukleotidů. Prekursor prochází složitým procesem vyzrávání a je z něho vyštěpeno několika kratších, vzájemně odlišných ribosomálních RNA. Ty představují organizační centrum pro vytváření malých a velkých ribosomálních podjednotek, které sestávají z ribosomálních RNA a desítek různých ribosomálních proteinů (bílkovin). Malé i velké podjednotky, které jsou již v podstatě vyzrálé, putují z jadérka jádrem a skrze jaderné póry se dostávají do cytoplazmy a v cytoplazmě poté dochází seskupením jedné malé a jedné velké ribosomální podjednotky k vytvoření funkčního ribosomu.
Ribosomy, a tedy i jadérka, jsou pro život buňky nepostradatelné, neboť jejich prostřednictvím dochází v cytoplazmě k překladu informace uložené v podobě sekvence nukleotidů mediátorové RNA (messenger RNA, mRNA) do sekvence aminokyselin syntetizovaných proteinů, tj. dochází k proteosyntéze. Na ribosomech dochází rovněž k proteosyntéze ribosomálních proteinů, přičemž příslušné molekuly mRNA jsou syntetizovány na genech pro jednotlivé ribosomální proteiny v jádře mimo jadérka. Vytvořené molekuly mRNA pro ribosomální proteiny odtud putují do cytoplazmy a na cytoplazmatických ribosomech dojde k syntéze ribosomálních proteinů. Ty pak putují do jádra a do jadérka, kde se stávají součástí nově vytvářených ribosomálních podjednotek.
|
|
|
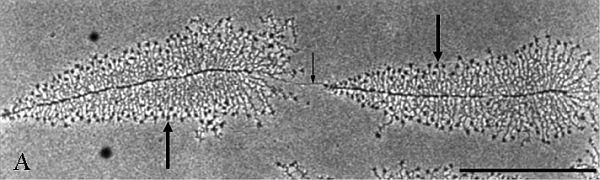
A. Dva roztažené transkribující ribosomální geny z oocytu obojživelníků ve snímku z elektronového mikroskopu. Tento nádherný snímek je pořízen po rozbití jadérka hypotonickým roztokem. Ve snímku je patrna molekula DNA (t.j. dva v tandemu uspořádané ribosomální geny), která představuje centrální osu. Na ni nasedají nascentní molekuly prekursorů ribosomální RNA vykazující zvyšující se délku. To odpovídá postupně narůstajícímu počtu nukleotidů zabudovaných do molekuly prekursoru. Konce nascentních RNA jsou zakončeny částicí (velké šipky) složenou z neribosomální RNA a neribosomálních proteinů. Tato částice hraje důležitou úlohu ve vyzrávání prekursoru ribosomální RNA. Geny jsou odděleny vmezeřenou sekvencí DNA (malá šipka), která není přepisována. Černá úsečka odpovídá 1.0 mikrometru. Tento typ snímků transkribujících ribosomálních genů se nazývá "vánoční stromeček", neboť DNA molekula připomíná kmen stromečku a nascentní prekursory ribosomální RNA jeho větve. Vzhledem ke složitosti tzv. chromatinových struktur se bohužel u savčích buněk, na rozdíl od kvasinek či oocytů hmyzu a obojživelníků, nedaří podobné snímky "vánočních stromečků" pořídit. |
Velikost a počet jadérek v jádře do značné míry souvisí s úrovní metabolismu buňky. Metabolicky málo aktivní buňky mohou vykazovat jedno či dvě drobná jadérka, vysoce aktivní buňky mají zpravidla více obrovských jadérek. Například "spící" lidské lymfocyty periferní krve obvykle vykazují jedno drobné jadérko o průměru zhruba jednoho mikrometru, ale po aktivaci (např. po antigenní stimulaci) mohou lidské lymfocyty vykazovat i více jadérek o průměru několika mikrometrů. Popsané rozdíly v morfologii a počtu jadérek souvisejí s úrovní syntézy ribosomální RNA.
Takto jsme velmi zjednodušeně shrnuli základní fakta o jadérku jako továrně na ribosomy. Objasňování regulace biogeneze ribosomů je dnes v popředí zájmu mnoha badatelských skupin a teprve v 21. století jsme v tomto ohledu svědky exponencionálního nárůstu vědomostí. Podařilo se tak zodpovědět řadu zásadních otázek, nicméně syntetický pohled na regulaci tvorby ribosomů stále chybí. Není např. známo, jak buňka pro své potřeby reguluje produkci ribosomů. Doposud byl všeobecně přijímán názor, že syntéza ribosomálních proteinů je regulována současně s produkcí ribosomálních RNA. Toto paradigma je zjevně rozbito. Výsledky nedávné studie s lidskými buňkami ukázaly, že ribosomální proteiny jsou ve srovnání se syntézou ribosomálních RNA produkovány v nadbytku, přičemž značná část těchto proteinů není použita při tvorbě ribosomálních podjednotek a je degradována. Navazující problém souvisí s existencí neaktivních a aktivních NORů. Některé NORy dané buňky mohou být plně umlčené, tj. na tandemově uspořádaných ribosomálních genech daného NORu nedochází k syntéze ribosomální RNA, zatímco aktivní NORy obsahují geny syntetizující ribosomální RNA. Mechanizmus přechodu z aktivního do neaktivního NORu v závislosti na změně proteosyntetických potřeb buňky, resp. pochodu obráceného, není dostatečně probádán. Rovněž není u lidských buněk znám rozsah aktivity jednotlivých genů v rámci daného aktivního NORu. Doposud se všeobecně soudilo, že pokud je NOR aktivní, pak všechny geny NORu jsou vysoce transkripčně aktivní. Toto paradigma je rovněž nyní vyvráceno. Výsledky z nedávné doby prokázaly, že v rámci jednoho tandemu ribosomálních genů u kvasinek lze vedle sebe najít jak geny vysoce aktivní, tak i prakticky neaktivní.
|
|
Je možné říci, že jsou to právě bílkoviny, které v buňce vykonávají "každodenní" mravenčí práci. Potřeba proteosyntézy je proto pro buňku zásadní a to vyžaduje neustálý přísun nových a nových ribosomů. Je proto pochopitelné, že syntéza ribosomální RNA odpovídá zpravidla více než 50 % celkové produkce RNA v buňce. To je zajištěno tím, že buňky obsahují desítky i stovky ribosomálních genů (v rostlinných buňkách i tisíce genů), které kódují ribosomální RNA. V lidské somatické (diploidní) buňce se jedná zhruba o 400 genů, rozmístěných na 5 párech akrocentrických chromosomů (chromosomy 13, 14, 15, 21 a 22; lidská diploidní buňka obsahuje celkem 22 párů chromosomů a v závislosti na pohlaví ještě buď dva chromosomy X nebo chromosomy X a Y). Ribosomální geny jsou v nich uspořádány ve skupinách za sebou, v tandemu, a tyto skupiny opakujících se genů jsou nazývány nukleolární organizátory, neboli NORy (Nucleolus Organizer Regions). Na každém z akrocentrických chromosomů se tak v jejich malém raménku nachází NOR s několika desítkami ribosomálních genů. Jadérka nepředstavují trvalou buněčnou strukturu. Buňka obsahuje jadérka pouze v interfázi, tj. v údobí mezi dvěma buněčnými děleními. Na začátku (mitotického) dělení dojde k útlumu syntézy ribosomální RNA a jadérka se rozpadnou. Na konci dělení dojde k reaktivaci tvorby ribosomální RNA a na počátku interfáze se opakující se ribosomální sekvence zpravidla ze dvou i více chromosomů obsahujících NOR shlukují a účastní se tvorby nově vznikajících jadérek. |
|
B-D. Elektronmikroskopické mapování transkripce ribosomálních genů v ultratenkém řezu jadérka lidských HeLa buněk. Jadérko obsahuje jako transkripčně aktivní geny výlučně ribosomální geny. Buňky do nascentních RNA molekul zabudovaly během několika málo minut modifikovaný nukleotid, který je možné specificky detegovat tzv. zlatými komplexy. V tomto případě byl použit zlatý komplex obsahující zlatou kuličku o průměru 6 nm. B představuje celkový pohled na jadérko, C a D detaily snímku v B (v B vyznačeno bílými čtverci). Zlaté kuličky (šipky v C a D) vytvářejí shluky. Shluky zlatých kuliček představují řezy skrze "vánoční stromečky", které jsou v buňce kompaktovány a různě v prostoru pokrouceny. V tomto ohledu je zajímavé porovnat délku jednoho plně roztaženého ribosomálního genu v A s velikostí jadérka v B.Bílá úsečka v B odpovídá 0.2 mikrometru, bílé úsečky v C a D odpovídají 0.5 mikrometrům. |
Nárůst našich vědomostí o jadérku byl výrazně ovlivněn modelem kvasinek. Tento model umožňuje jednoduše využít genetických manipulací a získané výsledky přitom často, ne však vždy, platí i u buněk vyšších organismů včetně buněk lidských. Tak se pomocí molekulárně biologických a biochemických přístupů, ve kterých se v konečně analýze používají in vitro bezbuněčné systémy, podařilo především díky kvasinkovému modelu charakterizovat rozsáhlou škálu biochemických procesů v biogenezi ribosomů. Nicméně ještě nedávno chyběl u kvasinek i u buněk vyšších organismů důležitý aspekt poznání - korelace biochemických procesů probíhajících v jadérku s nukleolárními strukturami pozorovanými v mikroskopu. Architektura buňky i jadérka potřebovala miliony a miliony let vývoje k tomu, aby zaručila optimální interakci svých komponent. Tu ovšem nelze vhodně postihnout v bezbuněčném systému. Proto se |
dnes mnoho badatelských skupin zabývá molekulární buněčnou biologií, která integruje biochemii, molekulární biologii a buněčnou biologii, a zkoumá buňku (a jadérko) i v buněčném kontextu. Úspěch molekulární buněčné biologie byl dán rozvojem nových typů mikroskopů a nových mikroskopických přístupů pro studium buňky, dnes snad především přístupů umožňujících pozorování buněk v čase. V těchto přístupech jsou v živých buňkách označeny mikroskopicky detegovatelnou značkou specifické proteiny (je možné označit i specifické molekuly RNA; je rovněž možné sledovat iontové změny apod.) a je v čase sledován jejich osud v buňce.
Získané výsledky přinesly mimo jiné i obrovské překvapení pro 21. století. Všeobecně se vědělo, že buňka, její jádro či jadérko jsou dynamické struktury. Ukázalo se však, že buněčné komponenty, včetně jaderných a jadérkových proteinů, jsou ve své valné většině nesrovnatelně více dynamické než se předpokládalo. Jaderné proteiny difundují více méně volně skrze jaderný prostor včetně jadérka a střední doba setrvání (residence time) většiny jadérkových proteinů v nukleolu je jen několik desítek vteřin. Ihned tak vystává otázka: Co vlastně stojí za existencí jadérka a jeho ustálenou (steady-state) strukturou během interfáze? Ještě na začátku tohoto století se všeobecně soudilo, že transkripční aktivita ribosomálních genů stojí za existencí jadérka a jeho ustálenou stukturou. Toto paradigma již neplatí, neboť bylo prokázáno, že aktivita ribosomálních genů je pro to podmínkou nutnou, ne však podmínkou dostačující. Ostatně součástí jadérka je i většina neaktivních NORů, které tak přispívají (neznámým způsobem) ke strukturní integritě jadérek. Integrita jadérka je zjevně uchována skrze interakci určitých proteinů s ribosomálními geny, čímž dojde k vytvoření více méně stabilního komplexu. Ten představuje strukturní základ, který umožní podmínky pro vytvoření komplexní množiny jadérkových interakcí v jakémsi "superkomplexu". Nukleoplazmatické složky se neustále vyměňují s tímto nukleolárním superkomplexem, přičemž "steady-state" struktura jadérka je zjevně výsledkem toho, že doba setrvání jadérkových proteinů v nukleolu je o jeden či více řádů delší než doba setrvání proteinů, které nejsou jadérku vlastní a které nenajdou v jadérku partnery, se kterými by mohly reagovat. Na jadérko lze tedy pohlížet jako na "steady-state" strukturu, která je v dynamické rovnováze s okolní nukleoplazmou.
V souvislosti s jadérkem se podařilo významně prohloubit funkční popis nukleolárních struktur ve smyslu metabolických procesů v nich probíhajících (viz obrázek). Mimo jiné také ultrastrukturální identifikací nascentních molekul ribosomální RNA, a tedy i aktivních ribosomálních genů. Mikroskopické přístupy rovněž umožnily identifikovat, i když prozatím jen u kvasinek, řadu kroků v maturaci prekursoru ribosomálních RNA.
Zásadní pokrok v našich vědomostech o jadérku byl umožněn zavedením funkční proteomické analýzy jadérka, především u lidských buněk. Na samém začátku 21. století bylo v jadérku lidské buňky identifikováno méně než 200 různých bílkovin. S adventem jadérkové proteomiky to v roce 2002 bylo již na 350 bílkovin, v roce 2005 již bezmála 700 proteinů. Současné výsledky analýzy izolovaných jadérek z různých typů lidských buněk svědčí o přítomnosti více než 2 000 proteinů, přičemž ne všechny proteiny byly identifikovány v nukleolech všech vyšetřovaných buněčných typů (dr. Angus Lamond, osobní sdělení).
Funkční proteomická analýza jadérka napomohla zodpovědět řadu "ribosomálních" otázek, ale také potvrdila a rozšířila vědomosti o neribosomálních funkcích jadérka. Ukazuje se, že jadérko má úlohu v regulaci buněčného cyklu, senescenci a regulaci funkce telomerasy, aktivitách onkogenů a supresorů nádorů, stresových situacích buňky, metabolismu molekul mRNA, maturaci "mimojadérkových" molekul RNA či kontrole virové infekce. Proč jadérko vykazuje tolik neribosomálních aktivit není známo. Vzhledem k exponenciálnímu nárůstu vědomostí o jadérku je však zřejmé, že se v blízké budoucnosti dočkáme odpovědí na řadu otázek souvisejících s ribosomálními i neribosomálními funkcemi jadérka. A zřejmě i řady překvapení.
prof. RNDr. Ivan Raška, DrSc.,
Ústav buněčné biologie a patologie, 1. LF UK v Praze a Oddělení buněčné biologie FgÚ AV ČR
Poděkování: Toto sdělení bylo podpořeno granty 304/04/0692, MSM0021620806, LC535 a AV0Z50110509.
Doporučená literatura:
Raška I., Shaw P., Cmarko D. (2006). Curr. Opin. Cell Biol., 18, 325-334.
Raška I., Shaw P., Cmarko D. (2006). Int. Rev. Cytol., 255, 177-235.
Obr. A. Zdroj: Alberts et al. Molecular Biology of the Cell, 4. vydání (2002), str. 305, Figure 6-9.
Obr. B-D. Zdroj: J. Cell Biology, 157, 743-748, 2002.